Химия
Тема 1: Краткий курс химииУрок 10: Знакомство с классами органических веществ. Углеводороды: классификация, получение и химические свойства
- Теория
Углеводороды – соединения, состоящие из атомов углерода и водорода, связанные ковалентной связью. По строению углеродного скелета углеводороды делятся на ациклические и циклические; по типу связей – на предельные, непредельные и ароматические.
Каждый вид углеводородов образует гомологический ряд, который имеет свою общую формулу.
Алканы (предельные углеводороды)
Алканы – углеводороды, в молекулах которых атомы углерода связаны между собой σ-связью, а остальные их валентности предельно насыщены атомами водорода. Отсюда другое название алканов – предельные углеводороды.
Рассмотрим некоторые способы получения алканов
Синтез Вюрца: получаем алкан с удвоенным числом атомов углерода
СН3Cl + 2Nа + СlСН3 → СН3–СН3 + 2NаCl
Восстановление непредельных углеводородов
СН2=СН2 + Н2 → СН3–СН3
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
Гидрированием ненасыщенных углеводородов
CH3 -CH=CH2 + H2 → CH3-CH2-CH3
Химические свойства алканов.
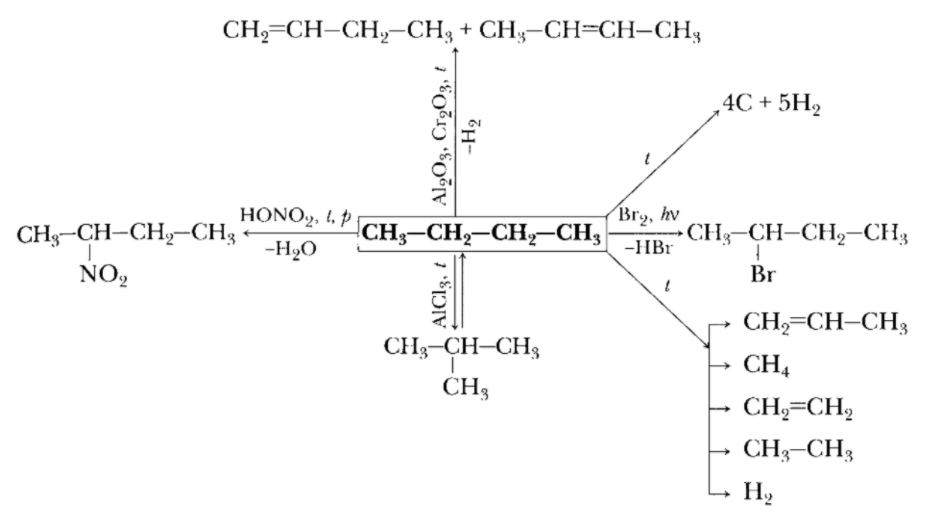
Предельные углеводороды при обычных условиях химически мало активны, что объясняется прочностью σ-связей между атомами углерода. Для алканов характерны реакции замещения атомов водорода на галогены (с бромом), на нитрогруппу (с азотной кислотой). При реакции дегидрирования (отщепления водорода) образуются алкены. И характерны реакции изомеризации – получение изомеров. Свойства алканов представлены на схеме на примере н-бутана
Следующий класс углеводородов – алкены (этиленовые углеводороды) - ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода
Алкены получают несколькими способами:

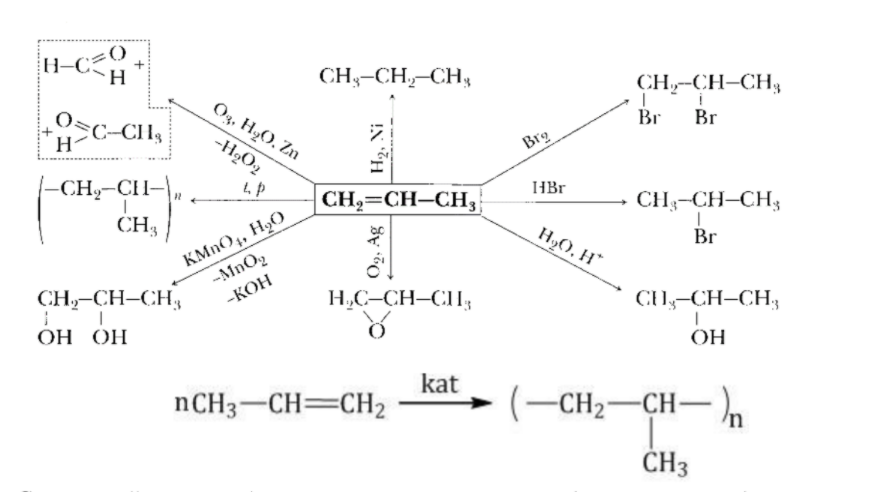
Алкены - ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны. Характерны реакции присоединения водорода, галогенов, гидрогалогенов, воды, реакции полимеризации. В присутствии катализаторов или сильных окислителей алкены окисляются до альдегидов или двухатомных спиртов. Свойства алкенов представлены на схеме на примере пропена
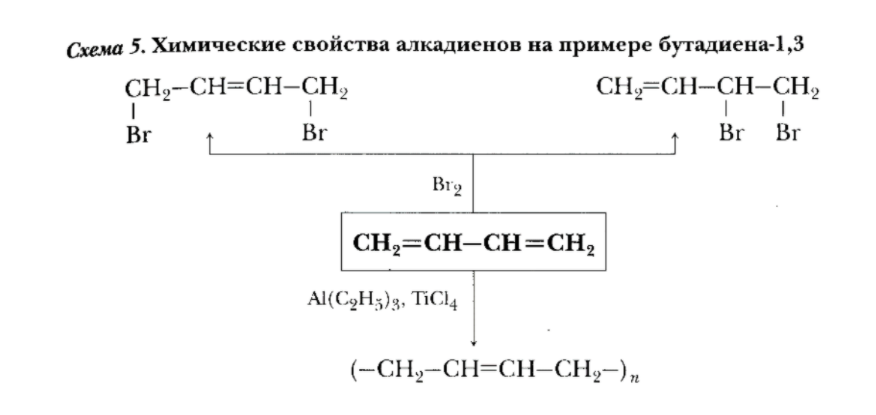
Следующий класс - Алкадиены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С.
Алкадиены получают несколькими способами:
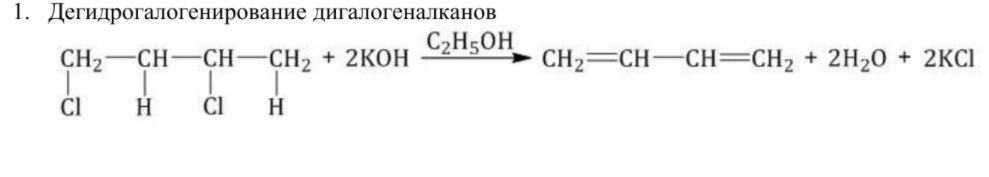
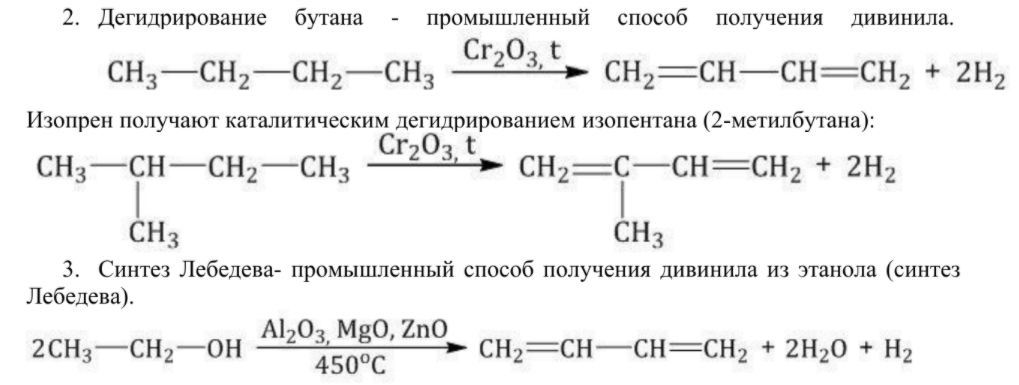
Химические свойства алкадиенов похожи на свойства алкенов, т.к. присутствует двойная связь. Но есть свои особенности. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
Свойства алкадиенов представлены на схеме на примере бутадиена-1,3
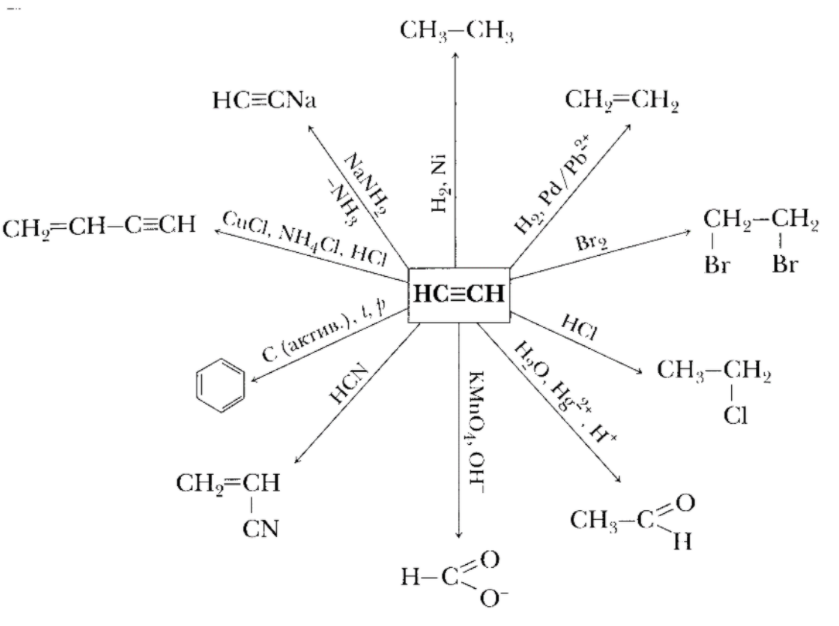
И знакомимся еще с одни классом Алкинами непредельными углеводородами, имеющие в молекуле одну тройную связь С≡С.
Зная химические свойства алкенов, понимая механизм протекания реакций, разобраться с химическими свойствами алкинов – нетрудно. Для алкинов, как и для алкенов, характерны реакции присоединения: водорода, галогенов, гидрогалогенов, воды. Так как тройная связь содержит две π-связи, реакции присоединения к алкинам могут происходить в две стадии. Вначале идет присоединение по месту двойной π-связи с образование производных олефинов, а затем по месту второй π-связи с образованием производных алканов.
В отличие от алкенов в алкинах могут идти реакции замещения. Характерны реакции окисления.
Свойства алкинов представлены на схеме на примере ацетилена
И рассмотрим еще один класс углеводородов – арены -ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи. Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Первый член гомологического ряда - бензол - C6H6. И рассматривать все свойства и получение мы будем для бензола. Начнем с получения бензола
1) Бензол получают из нефти и каменноугольной смолы, образующейся при коксовании каменного угля.
2) Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов):
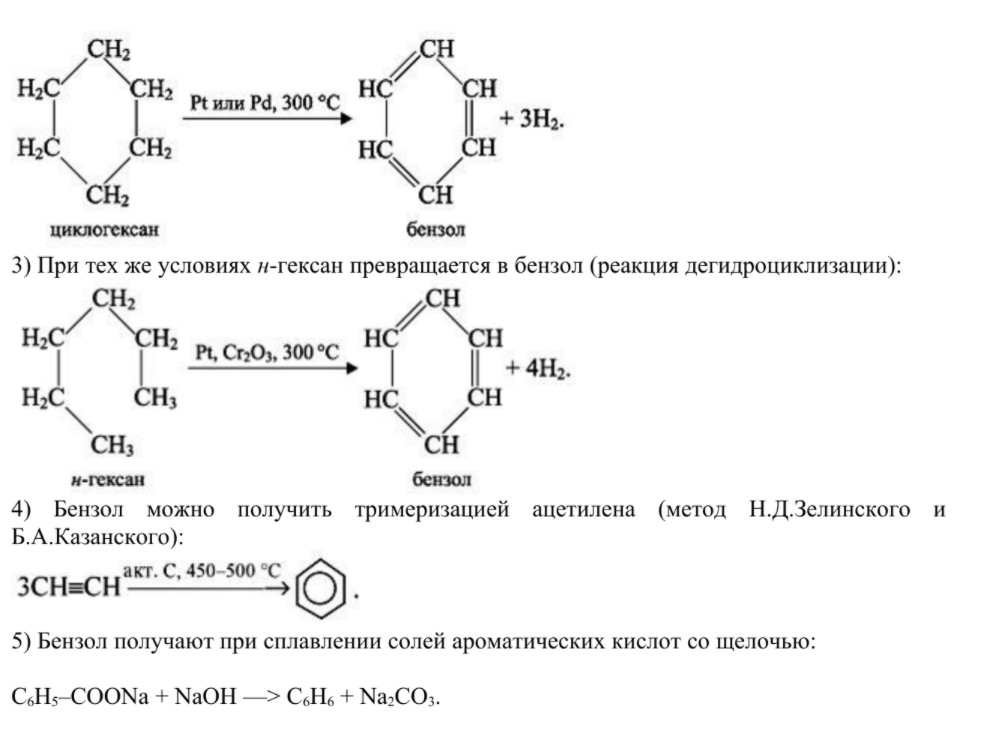
Химические свойства. Ядро бензола обладает большой прочностью. Этим и объясняется склонность аренов к реакциям замещения. Они протекают легче, чем у предельных углеводородов. ● Реакция замещения идут только в присутствии катализаторов: галогенирования, нитрования, гидрирования. В отличие от алкенов бензол не присоединяет галогеноводороды и воду. Бензол очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор KMnO4. Бензол на воздухе горит коптящим пламенем. Свойства бензола представлены на схеме